Сёння навучэнец павінен не толькі ўладаць пэўнымі ведамі, але і прымяняць іх у паўсядзённым жыцці, у працэсе сваёй дзейнасці, для вырашэння жыццёвых пытанняў. Паспяхова з такой задачай спраўляюцца практыка-арыентаваныя заданні. Выкананне такіх заданняў у працэсе навучання садзейнічае развіццю ўменняў перапрацоўваць, аналізаваць, самастойна знаходзіць і прымяняць веды ў розных сітуацыях. Гэта ёсць спосаб фарміраваць у навучэнцаў прыродазнаўчанавуковую, матэматычную і чытацкую граматнасць, развіваць крытычнае і крэатыўнае мысленне, медыаадукацыйную кампетэнцыю, выхоўваць гонар за сваю краіну і яе дасягненні, экалагічную культуру і адказныя адносіны да свайго здароўя і жыцця.
Валянціна РАМАНЮК,
настаўнік хіміі
ДУА “Янавіцкая сярэдняя школа Клецкага раёна”,
Мінская вобласць
Тэма: «Рашэнне практыка-арыентаваных задач па тэме “Аксіды”».
Мэта: арганізацыя і стымуляванне вучэбнай дзейнасці вучняў па авалоданні ведамі, уменнямі і навыкамі па тэме “Аксіды”.
Задачы:
– замацаваць і паглыбіць атрыманыя веды па тэме “Аксіды” шляхам выканання практыка-арыентаваных заданняў рознай складанасці;
– развіваць уменні практычнага прымянення тэарэтычных навыкаў; уменні рашаць разліковыя задачы, з выкарыстаннем асноўных формул і алгарытму рашэння задач па ўраўненню хімічнай рэакцыі; уменні эксперыментальных даследаванняў, уменні назіраць, аналізаваць і рабіць высновы; працаваць з дадатковай літаратурай;
– фарміраваць у вучняў навуковы светапогляд; усведамленне ролі хіміі ў пазнанні свету і практычнай дзейнасці; паважлівага стаўлення да меркавання апанента пры абмеркаванні праблем; культуры бяспекі жыццядзейнасці, каштоўнасных адносін да свайго здароўя, вызначэнне ролі хіміі ў эканоміцы Рэспублікі Беларусь.
Абсталяванне: дыдактычны матэрыял (схема, карткі – тэксты задач, інструкцыя выканання лабараторнага доследу); перыядычная сістэма Д.І.Мендзялеева; рэактывы (стужка магнію, індыкатар метыларанж, аксід кальцыю і аксід магнію, вада); штатыў з прабіркамі, хімічная шклянка; мультыборд, камп’ютар, калькулятар, мультымедыйная презентацыя.
Тып урока: камбінаваны ўрок.
Эпіграф да ўрока: “Проста ведаць – гэта яшчэ не ўсё, веды неабходна ўмець прымяняць”, – Іаган Вольфганг Гётэ (Слайд 3).
Ход урока
I Арганізацыйны момант
Настрой на працу.
Лагічныя ланцужкі (Слайд 2).

Зварот да эпіграфа
II Актуалізацыя ведаў. Праверка дамашняга задання
Заданні, якія выконваюцца на сэнсарнай панэлі.
1. Запоўніце табліцу (Слайд 4).

2. Знайдзіце адпаведнасць і закончыце ўраўненні рэакцый (Слайд 5).
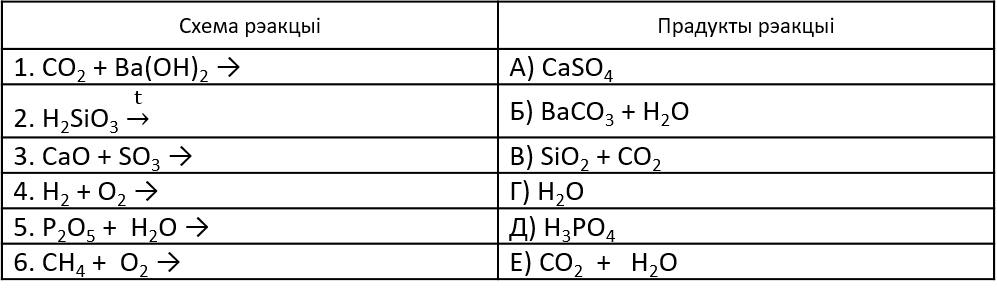
3. Запоўніце схему і растлумачце яе. (Каля дошкі).

4. Выканайце інтэрактыўны тэст. (На камп’ютары.)
1. Вызначце рад, у якім знаходзяцца аксіды:
1) Fe2O3 KOH H2SiO3
2) AI(OH)3 NaOH Ba(OH)2
3) CO2 CaO CuO
4) AICI3 Fe(OH)2 NaCI
2. Вызначце рад, у якім знаходзяцца ўсе асноўныя аксіды:
1) CuO SO2 Na2O
2) N2O5 K2O AI2O3
3) Fe2O3 CO2 P2O5
4) K2O BaO CuO
3. Вызначце рэчыва, з якім НЕ рэагуе аксід серы (IV):
1) H2SO4
2) Na2O
3) KOH
4) H2O
4. Укажыце схему рэакцыі, у выніку якой утвараецца аксід:
1) CH4 →
2) MgCO3 →τ
3) HCI + Fe →
4) AI(OH)3 + H2SO4 →
5. Аксід магнію з’яўляецца асноўным. Выберыце рэчыва, з якім рэагуе:
1) з кіслародам
2) з асноўным аксідам
3) з кіслатою
4) з соллю
6. Выберыце схему магчымай рэакцыі:
1) BaO + CO2→
2) CuO + H2O →
3) SO3 + HNO3 →
4) Cu + HCI →
7. Выберыце вобласць, у якой не прымяняецца СО2:
1) пажаратушэнне
2) харчовая прамысловасць
3) вытворчасць будаўнічых матэрыялаў
4) вытворчасць фарбаў
8. Вызначце схему рэакцыі, у выніку якой утвараецца соль:
1) CO2 + H2O →
2) CO2 + CaO →
3) CH4 + O2 →
4) CuCO3
9. Выберыце лішняе:
1) CuO
2) Na2O
3) P2O5
4) FeO
10. Выберыце лішняе:
1) CaSO3
2) CaO + H2O →
3) CaO + CO2 →
4) CaO + HCI →
III Выкананне заданняў
Пачнём з паўтарэння алгарытму рашэння задачы па ўраўненні хімічнай рэакцыі (Слайд 6).
Алгарытм
1. Вызначце з умовы задачы, якая рэакцыя адбываецца, якія рэчывы з’яўляюцца зыходнымі, а якія – прадуктамі.
2. Састаўце схему працякання рэакцыі.
3. Расстаўце каэфіцыенты ў схеме, ператварыце схему ва ўраўненне хімічнай рэакцыі.
4. З ураўнення рэакцыі вызначыце залежнасць паміж хімічнымі колькасцямі рэчываў, аб якіх ідзе размова.
5. Правядзіце неабходныя матэматычныя разлікі.
Задача 1 (Слайд 7)
Абпаленая магнэзія (аксід магнію) – гэта лёгкі белы парашок, які атрымліваюць абпальваннем мінералу магнэзіту (MgCO3). Абпаленая магнэзія выкарыстоўваецца пры ачыстцы нафтапрадуктаў, пры вырабе цэменту. Спартсмены і скалалазы апрацоўваюць ёю рукі, каб прадухіліць слізганне. У медыцыне абпаленую магнэзію прымяняюць пры павышанай кіслотнасці страўнікавага соку, колькасць якой абумоўлена ўтрыманнем салянай кіслаты.
1) Састаўце хімічнае ўраўненне, у выніку якога ўтвараецца абпаленая магнэзія. Назавіце рэчывы.
2) Растлумачце прымяненне абпаленай магнэзіі ў медыцыне. Састаўце ўраўненне хімічнай рэакцыі, якая адбываецца ў страўніку. Вызначце яе тып.
3) Разлічыце масу (г) хлоравадароднай кіслаты, якую можна нейтралізаваць аксідам магнію масай 8 г.
Дэманстрацыйны дослед (таксама спосаб атрымання аксіду магнію)
НПБП Спальванне стружкі магнію (запісаць ураўненне хімічнай рэакцыі).
Загадка (Слайд 8).
Каб з’явіцца я сумеў,
Гартуюць белы мел.
Мяне дае агеньчык печкі
І полымя маленькай свечкі.
Зрабіць патрэбна толькі ўздых,
Каб я на свет з’явіўся ўміг.
Я і ў газіроўцы ёсць, і ў коле,
У дыме, у хлебе – я наўкол! (Вуглякіслы газ)
Задача 2 (Слайды 9, 10)
Вогнетушыцель вуглекіслотны – адзін з першых сродкаў пажаратушэння, дзякуючы якому можна хутка ліквідаваць узгаранне. Яго балон запоўнены вуглякіслым газам, які знаходзіцца пад вялікім ціскам. Перавагай гэтага вогнетушыцеля перад астатнімі з’яўляецца яго ўласцівасць не пакідаць слядоў пасля сябе, а таксама тушыць электраабсталяванне пад напружаннем.
1) Разлічыце, які аб’ём (н.у.) зойме 2 кг вуглякіслага газу, што знаходзіцца ў вогнетушыцелі.
2) Растлумачце, чаму пасля прымянення вогнетушыцеля неабходна добра праветрыць памяшканне.
Фізкультхвілінка (Слайд 11)
Хімічны дослед (Слайд 12)
Аксід кальцыю ў прамысловасці атрымліваюць у вялікіх колькасцях, паколькі ён мае шырокае прымяненне, напрыклад, у вытворчасці сілікатнай цэглы, атрыманне металічнага кальцыю і, нават, у побыце. Людзі, якія захапляюцца садаводствам, ведаюць гэты аксід пад назвай “нягашаная вапна”. Ведаюць, што з вапнай неабходна асцярожна абыходзіцца.
Пасля правядзення доследу, адкажыце, чаму трэба працаваць з аксідам кальцыю ў пальчатках і халаце?
Дослед НПБП
У пранумараваных прабірках знаходзяцца аксіды P2O5 і CaO. Доследным шляхам вызначце, у якой з прабірак знаходзіцца кожнае з рэчываў. Адкажыце на пастаўленае пытанне.
Ход даследавання
1. Уважліва разгледзьце змесціва прабірак. Адзначце асаблівасці.
2. Дабаўце 3–4 см3 вады і старанна перамяшайце.
3. У кожную прабірку капніце некалькі кропляў індыкатару метыларанжу.
4. Адзначце змяненні.
5. Абгрунтуйце вашы назіранні, запішыце ўраўненні рэакцый.
6. Зрабіце вывад.
Паведамленне
Магнетыт, “жалезная акаліна”, змешаны аксід жалеза Fe3O4 (Fe2O3 *FeO). Еўрапейцы пачалі яго ўжываць яшчэ ў XII стагоддзі, а кітайцы і таго раней.
Імператар Хуанг-ці тры тысячы гадоў таму дзякуючы магнетыту атрымаў вялікую перамогу. На павозкі, якія ішлі ў бой, ён усталяваў фігуры з выцягнутай рукой, якія заўсёды паказвалі на поўдзень. Дзякуючы гэтаму ён змог пад прыкрыццём туману зайсці з тылу і разграміць ворага.
У Кітаі магнетыт ужывалі для будаўніцтва брам і дарог. Так, у горад не мог увайсці ўзброены чалавек, паколькі шчыльныя масівы магнетыту ператвараюцца ў магніт і прыцягваюць металічныя прадметы, уключаючы нажы, мячы, сякеры і іншую зброю.
Але самы вядомы ў старажытным свеце выраб з магнетыту – компас. Кавалачак каменя падвешвалі на вяровачку або мацавалі на дошчачку, апушчаную ў ваду. Такія компасы выкарыстоўвалі маракі, падобная прылада была незаменна і для караванаў, якія перасякалі пустыню.
Інфармацыя з “Вікіпедыі”
Асноўная дыягнастычная прымета – магнітныя ўласцівасці. Невялікія кавалачкі прыцягваюцца магнітам, а буйныя масы самі становяцца магнітам. Цікава, што пры награванні да 580 °С магнетызм знікае, але пры астыванні аднаўляецца.
Магнетыт выкарыстоўваецца як руда, з якой атрымліваюць сталь.
У Беларусі выяўлены радовішчы жалезных руд – Аколаўскае і Навасёлкаўскае (Слайд 13). Буйнейшым і вывучаным з’яўляецца Аколаўскае радовішча, размешчанае ў Стаўбцоўскім раёне Мінскай вобласці. Галоўны рудны мінерал – магнетыт. Запасы руд да глыбіні 700 м складаюць 440 млн т, папярэднія ацэнкі паказваюць, што на радовішчы магчыма будаўніцтва горна-абагачальнага камбіната з прадукцыйнасцю 9,4 млн. т руды ў год.
Задача 3.
1) Запішыце ўраўненне хімічнай рэакцыі паміж жалезам і кіслародам, якая адбываліся ў нетрах зямлі.
2) Разлічыце масу жалеза, якое праўзаемадзейнічала з кіслародам, калі маса магнетыту роўнай 232 г. (Рашэнне задачы – як дамашняе заданне)
Паэтычная хвілінка (Слайд 14)
А по утрам волшебно очень
Кружатся листья во дворе.
И, если вы влюбились в осень,
То это было в октябре!
Колеры восені – жоўты, чырвоны, рыжы, аранжавы.
Жоўтыя жалезааксідныя пігменты могуць выкарыстоўвацца для вытворчасці самых розных тыпаў фарбаў. Яны таксама прымяняюцца пры афарбоўцы пластыку, для абліцовачных работ у будаўніцтве і афарбоўкі драўляна-стружкавых вырабаў (Слайд 15).
IV Абагульненне
Кросенс (Слайд 16)

V Дамашняе заданне (Слайд 17)
1. Задача на картцы.
2. Зборнік с. 39 № 171, міні-паведамленне “Аксід і яго выкарыстанне” (агляд задачы ТіСІ4 Ti(OH)4 TiO2)
VI Вынікі ўрока
VII Рэфлексія
– Ці папоўнілася сёння ваша “скарбонка” ведаў?
– Ці падабаецца вам рашаць такія задачы?
“Лесвіца поспеху”





 Предложить публикацию
Предложить публикацию