Наталья ХЛЕБОВИЧ,
учитель химии и биологии
ГУО “Средняя школа № 1 г. Новогрудка”,
Гродненская область
Цель: планируется, что к концу урока учащиеся
– углубят свои знания о строении, физических и химических свойствах основных кислородсодержащих соединений фосфора, будут иметь представление о качественной реакции на фосфат-ионы;
– будут уметь составлять соответствующие уравнения химических реакций, выполнять лабораторные опыты, анализируя их и формулируя выводы;
– продолжат формировать навыки ЗОЖ.
Задачи личностного развития учащихся:
– развивать умения логически мыслить, сравнивать, анализировать, находить причинно-следственные связи, обобщать, делать выводы;
– способствовать развитию познавательного интереса к предмету;
– содействовать формированию умения работать в коллективе, воспитывать культуру безопасной жизнедеятельности и здорового образа жизни.
Оборудование: учебное пособие для 9-го класса учреждений общего среднего образования с русским языком обучения под редакцией И.Е.Шимановича, оборудование для лабораторной работы, карточки с заданиями, электронный тест «Кислородсодержащие соединения фосфора», смартфоны с выходом в интернет.
Методы обучения: частично-поисковый, проблемный, исследовательский.
Форма работы: фронтальная, индивидуальная, групповая.
Тип урока: урок усвоения новых знаний, применение их на практике.
Эпиграф: «Я не могу управлять направлением ветра. Но я всегда могу поставить паруса так, чтобы достичь своей цели», – О.Уайльд.
Ход урока
I Организационный момент
Учитель: Здравствуйте, ребята! Мне приятно видеть вас сегодня на уроке. Хочу пожелать нам всем, чтобы он прошёл активно, познавательно, успешно. Ребята, я предлагаю начать занятие с вопросов, которые позволят вспомнить все, что вы знаете о фосфоре и не только, для того чтобы изучение новой темы было продуктивно.
II Актуализация опорных знаний
Опрос учащихся по теме «Фосфор»
Вопросы
1) Где расположен фосфор в периодической таблице химических элементов Д.И.Менделеева? (Фосфор расположен в 3-м периоде, 5-й группе главной подгруппе периодической таблицы химических элементов Д.И.Менделеева)
3) Сколько энергетических уровней у атома фосфора? (У атома фосфора 3 энергетических уровня)
3) Сколько электронов на внешнем энергетическом уровне находится у атома фосфора? (У атома фосфора на внешнем энергетическом уровне находится 5 электронов)
4) Перечислите валентности фосфора. (III, V)
5) Назовите высшую и низшую степени окисления фосфора? (Высшая – +5, низшая – -3)
6) В виде каких аллотропных модификаций встречается фосфор? (Фосфор образует несколько аллотропных модификаций: белый, красный и черный фосфор).
7) Как из белого фосфора получить красный? (На свету при t 300* без воздуха)
8) Чем отличается белый фосфор от красного? (Белый фосфор не растворим в воде, летуч, легкоплавок. Белый фосфор очень ядовит, светится в темноте. Красный фосфор не растворяется в воде, не летуч, не ядовит и не светится в темноте).
9) Какие свойства фосфор проявляет в реакциях? (Фосфор в реакциях бывает восстановителем (с кислородом), с металлами проявляет окислительные свойства).
10) Где применяется фосфор? (Фосфор применяют в производстве фосфорной кислоты, лекарственных препаратов, в производстве спичек).
11) На какие группы делятся оксиды? (Кислотные, основные, амфотерные).
12) Перечислите свойства кислот (С металлами, основными оксидами, основаниями, солями).
Учитель: Справились с вопросами неплохо. Вижу, о фосфоре как простом веществе и элементе вы знаете достаточно. Теперь мы должны изучить его… что? (Соединения)
III Изучение нового материала
Учитель: Продолжаем изучать неметаллы и их соединения. Тема урока: Оксиды фосфора. Фосфорная кислота.
Давайте вместе определим задачи урока (Учащиеся высказывают свои предположения, далее учитель обобщает). На уроке вам предстоит:
– изучить разнообразие кислородсодержащих соединений фосфора;
– определить свойства этих веществ;
– рассмотреть качественную реакцию на фосфаты;
– выяснить области применения фосфорной кислоты и её солей.
Всё в ваших руках. И здесь я бы хотела обратиться к эпиграфу нашего урока….
Как вы думаете, где могут пригодиться знания, которые вы получите при изучении сегодняшней темы?
Постановка проблемы учителем, которая создаёт мотивационную основу для активного изучения нового материала (фото кока-колы и других продуктов на слайде).
Как вы думаете, почему при изучении данной темы, мы видим все эти продукты? Кока-колу?
Фосфорная кислота, является важным составляющим кока-колы. Она делает аромат более интенсивным, добавляет терпкость, а также замедляет рост бактерий и плесени. Она также содержится в консервированных чаях со льдом, кофейных напитках, батончиках из хлопьев для завтрака, в немолочных сливках и в улучшенных куриных и мясных продуктах.
Учитель: Чрезмерное употребление кока-колы приводит к такому недомоганию, как диарея, спазмы желудка, тошнота и рвота. Человек часто бывает вялым, раздражительным, у него появляются проблемы с почками, кости становятся более хрупкими. Почему? (с точки зрения химии)
Чтобы ответить на этот вопрос познакомимся поближе с соединениями фосфора.
Среди н/о соединений фосфора наибольшее значение имеют оксиды фосфора, фосфорная кислота и её соли.
Чтобы их максимально быстро и хорошо изучить, мы разделимся на три группы. Каждая группа получает карту с заданиями, по которой будет работать определённое количество времени (Приложение 1). Работа будет считаться эффективной, только в том случае, если задействованы все учащиеся группы. Чтобы ответить на поставленные вопросы, можно пользоваться учебниками и материалом из интернета. Во время отчета представителей каждой группы все остальные внимательно слушают и записывают всё в тетрадь (учитель по необходимости помогает и направляет работу групп).
Физкультминутка
Я называю формулы веществ – вы должны определить класс веществ и выполнить соответствующее движение:
оксид – встать, кислота – поднять руки, основание – хлопок, соль – кивок головой.
CaO, NaOH, CaCO3, NaNO3, H2S, H2O, HCl, ZnSO4, CO2, Fe(OH)3, H3PO4, Ba(OH)2
Работа учащихся по группам
1-я группа
Изучает разновидности, свойства и применение оксидов фосфора.
Р2О3 и P2O5 – КИСЛОТНЫЕ (вода, осн. оксид. основание).
Твердое белое вещество Р2О5 гигроскопично и используется как водоотнимающее средство.
1) P2O5 + 3H2O → 2H3PO4 ПОЛУЧЕНИЕ!
2)P2O5 +6NaOH → 2Na 3PO 4 + 3H2O
Изучаем все вместе
Строение кислоты (стр. 133) Н3 РО4
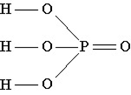
В – V; CO – +5
Физические свойства. Фосфорная кислота представляет собой бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
Диссоциация кислоты. Слабый электролит (диссоциирует обратимо).
Фосфорная кислота диссоциирует ступенчато:
Н3РО4 ↔ 3 H+ + PO43–
Соли фосфорной кислоты – ФОСФАТЫ
2-я группа
Изучает химические свойства Н3РО4, основываясь на ранее полученных знаниях о кислотах в целом.
3Mg + 2H3PO4 → Mg3(PO4)2 + 3H2↑
H3PO4 + 3NaOH → Na3PO4 + 3H2O
3-я группа
Изучает качественную реакцию на фосфат-ионы, пользуясь блогом «Просто химия» (ресурс: http://prostohimia.blogspot.com/).
Учитель: Внимание, прежде чем приступить к выполнению эксперимента ознакомьтесь с ПБП.
К3PO4 + 3AgNO3 → Ag3PO4 ↓ + 3HNO3
Это качественная реакция на фосфаты.
Чтобы лучше запомнить эту качественную реакцию, я предлагаю вам провести исследование по обнаружению веществ.
Химический эксперимент
Задание: В трех пробирках находятся следующие растворы солей натрия: фосфат натрия, нитрат натрия, хлорид натрия. Используя один реактив, определите, в каких пробирках (под каким номером) находится каждое из этих веществ? Результаты эксперимента запишите в тетради.
Изучаем все вместе
Применение фосфорной кислоты и фосфатов (стр.134).
– в производстве фосфорных удобрений;
– в производстве кормовых добавок для животноводства;
– в производстве моющих средств (фосфаты щелочных металлов);
– для создания защитных покрытий на металлах.
IV Закрепление
1) Фронтальный опрос:
1) Какие соединения фосфора вы знаете?
2) Назовите физические свойства Р205.
3) Перечислите химические свойства фосфорной кислоты.
4) Как называются соли фосфорной кислоты?
5) Что является качественной реакцией на фосфаты?
6) Где применяются фосфорная кислота и её соли?
2) Онлайн-тест на блоге «Просто химия»
3) Можем ли мы теперь ответить на вопрос, который был в начале урока?
4) Анализ фактов о Н3РО4
5) Проверь себя
Закончите высказывания:
1) Оксид фосфора (V) образуется при горении …
2) Формула фосфорной кислоты…
3) Фосфорную кислоту получают из …
4) Фосфорная кислота – это … вещество, …растворимое в воде.
5) Качественная реакция на фосфорную кислоту и ее соли – это взаимодействие с … . Признак реакции – …
6) Фосфорная кислота даёт соли …
7) Фосфорная кислота применяется в производстве …
Работа с цепочками превращений по вариантам (Приложение 2)
V Подведение итогов урока
Учитель: Подведем итог нашей работы и выясним, все ли задачи урока достигнуты? (Возвращаемся к задачам урока, озвучиваем их ещё раз, и анализируем их достижение).
Выставление и комментирование отметок за урок.
«9» – глубокие и полные знания, свободно ориентируешься в теории, используешь её при решении поставленных задач, используешь знания из других дисциплин (единичных неточностей сами исправляют)
«10» – применяют знания в незнакомых, нестандартных ситуациях.
«8» – применение знаний по образцу, незначительные неточности.
«7» – знания с несущественными ошибками, не может применить
Д/з – § 28, з. 5, 8. Творческое задание: выяснить, какие ещё существуют кислоты, содержащие фосфор, кроме фосфорной, сделать о них мини-сообщение.
VI Рефлексия
Если вы считаете, что знания, полученные на сегодняшнем уроке, вам пригодятся в жизни, бросьте фишку в контейнер, где нарисован портфель. Если вы не определились – в контейнер с нарисованной мельницей, а если не пригодятся знания – в контейнер с нарисованным ведром.
Приложение 1
Задания для групп
1-я группа
Оксиды фосфора (с. 132–133).
Какие оксиды существуют у фосфора? Они являются кислотными или основными?
Перечислите физические свойства оксида фосфора (V)?
С какими веществами реагирует оксид фосфора (V)?
Из чего можно получить фосфорную кислоту?
Закончите уравнения реакций:
P2O5 +H2O → … ;
P2O5 + NaOH → … + … .
Где используется оксид фосфора (V)?
2-я группа
Химические свойства фосфорной кислоты (с. 133–134).
Как вы думаете, с чем может реагировать фосфорная кислота? Перечислите.
Закончите уравнения реакций:
H3PO4 + Mg→ … + …;
2) H3PO4 + NaOH → …+ …;
Уравнение 2 напишите в молекулярном, полном и сокращённом ионном видах.
3-я группа
Качественная реакция на фосфат-ион (изучить на блоге «Просто химия» (https://prostohimia.blogspot.com).
Какая реакция является качественной для фосфатов? Что в результате её можно увидеть?
Докажите экспериментально, что выданная вам соль К3PO4, является фосфатом. Внимание, прежде чем приступить к выполнению эксперимента ознакомьтесь с ПБП.
Инструкция: Возьмите чистую пробирку. Налейте в неё 1 мл фосфата калия и добавьте 1 мл нитрата серебра. Наблюдается выпадение … осадка – фосфата серебра.
Закончите уравнение реакции:
К3PO4 + АgNO3 → … + … .
Напишите его в молекулярном, полном и сокращённом ионном видах?
Химический эксперимент.
Задание: В трех пробирках находятся следующие растворы солей натрия – фосфат натрия, нитрат натрия, хлорид натрия. Используя один реактив, определите, в каких пробирках (под каким номером) находится каждое из этих веществ? Результаты эксперимента запишите в тетради.
Приложение 2
Задания для закрепления знаний по теме «Оксиды фосфора и фосфорная кислота»
1 Осуществите превращения
Вариант I
Р 2О 5 → Н 3РО 4 → Na 3PO 4 → Ca 3(PO 4) 2 → H 3PO 4 → Zn 3(PO4) 2
Вариант II
PH 3
↑
P → Р 2О 5 → Na 3PO 4 → Ag 3PO 4
↓
Ca 3P 2
2 Дополнительные задания
1) Составьте уравнения реакций оксида фосфора (V) с
– Na2O
– NaOH
– H2O при нагревании
Для 2-й реакции запишите полное и краткое ионное уравнение.
2) Составьте молекулярные и ионные уравнения реакций фосфорной кислоты с:
– калием
– оксидом калия
– гидроксидом калия
– сульфитом калия
3) Осуществите превращения по схеме:
P -> PH3 -> P2O5 -> H3PO4 -> Ca3(PO4)2
Назовите вещества.
4) Вычислите (в %), какое из фосфорных удобрений: двойной суперфосфат (Ca(H2PO4)2 или преципитат (CaHPO4 * 2H2O) богаче фосфором? Химические формулы удобрений найдите в схеме самостоятельно.
5) Суточная потребность человека в фосфоре составляет по массе 1 г. Массовая доля содержания фосфора в продуктах питания (%): в мясе – 0,204; в яйцах – 0,224; в сыре – 0,701. Какую массу каждого продукта нужно ввести в рацион, чтобы удовлетворить суточную потребность организма в фосфоре?



 Предложить публикацию
Предложить публикацию