Метады навучання: тлумачальна-ілюстрацыйны, праблемна-пошукавы, рэпрадуктыўны, дэманстрацыйныя і лабараторныя доследы (эксперыментальны).
Вольга ЯНЧУК,
настаўнік хіміі і біялогіі
ДУА “Уселюбская сярэдняя школа”
Навагрудскага раёна,
Гродзенская вобласць
Тэма: Азотная кіслата.
Мэты:
– развіваць веды пра кіслоты на прыкладзе азотнай кіслаты;
– акцэнтаваць увагу на асаблівасцях узаемадзеяння азотнай кіслаты з металамі;
– вывучыць асновы прамысловага атрымання азотнай кіслаты, рэакцыі тэрмічнага раскладання нітратаў;
– сфарміраваць уяўленне пра прымяненне азотнай кіслаты і нітратаў;
– развіваць эксперыментальныя ўменні і навуковае мысленне вучняў у працэсе ўстанаўлення прычынна-выніковых сувязей, параўнання і назірання аб’ектаў і працэсаў, прымянення ведаў і ўменняў у новых сітуацыях;
– выхоўваць патрыятызм, каштоўнасныя адносіны да свайго здароўя.
Тып урока: камбінаваны.
Метады навучання:
– тлумачальна-ілюстрацыйны
– праблемна-пошукавы
– рэпрадуктыўны
– дэманстрацыйныя і лабараторныя доследы (эксперыментальны)
Прыёмы навучання:
– пастаноўка праблемных пытанняў
– эксперымент
Формы работы: індывідуальная, франтальная.
Абсталяванне: на сталах – наборы рэактываў для індывідуальнай работы, праверачныя заданні.
Эпіграф урока: “Страх перад магчымасцю памылкі не павінен адхіляць нас ад пошукаў ісціны”, – К.А.Гельвецый.
Ход урока
1 Арганізацыйны момант
Мэта: стварыць пазітыўны настрой.
2 Актуалізацыя ведаў
2.1 Праверка дамашняга задання
Мэта: праверыць узровень засваення матэрыялу па тэме “Аміяк”.
1. Аміяк – гэта лятучае вадароднае злучэнне азоту.
а) дакладнае сцвярджэнне;
б) няправільнае сцвярджэнне;
2. Высокая тэмпература кіпення і растваральнасць аміяку ў вадзе абумоўлена ўтварэннем ______________ сувязей паміж малекуламі.
3. Выберыце сцвярджэнні, якія характарызуюць уласцівасці аміяку:
а) выкарыстоўваецца пры вытворчасці ўгнаенняў;
б) рэагуе з солямі;
в) змяняе афарбоўку фенолфталеіну на малінавы колер;
г) pH раствору менш за 7;
д) у прамысловасці атрымліваюць эндатэрмічнай рэакцыяй;
е) рэагуе з кіслотамі.
4. Соль амонію ўтворыцца пры ўзаемадзеянні:
а) нітрату амонію з водным растворам гідраксіду калію;
б) аміяку з водным растворам хлоравадароду;
в) хларыду амонію з растворам нітрату срэбра (I);
г) воднага раствору аміяку з сульфатам калію.
5. Разлічыце малекулярную масу сумесі газаў, якая складаецца з 33,6 г азоту і 13,6 г аміяку.
Адказ: ___________________
Ключ адказаў: 1 – а; 2 – вадародных; 3 – а, в, е; 4 – б, в; 5 – 23.
2.2 Матывацыя
Мэта: арганізаваць дзейнасць вучняў па вызначэнні тэмы ўрока і пастаноўкі мэтаў.
Праблемнае пытанне: Манах-алхімік Банавентура ў 1270 годзе ў пошуках універсальнага растваральніка “алкагеста” вырашыў нагрэць сумесь жалезнага купарвасу з салетрай. Пасудзіна, у якой была сумесь, неўзабаве напоўнілася чырвона-бурым “дымам”. Манах у здзіўленні застыў, затым прыняў агонь і ўбачыў, як у колбу-прыёмнік стала капаць жаўтаватая вадкасць. Яна дзейнічала на ўсе металы, нават на серабро і ртуць. Алхімікі думалі, што рыжы дым, які сядзіць у вадкасці, з’яўляецца дэманам, які кіруе адной са стыхій прыроды – вадой. Таму вадкасць звалі “моцнай гарэлкай”. Гэта назва захавалася да часоў М.В.Ламаносава.
– Як зараз называюць гэта рэчыва? (Адказ на пытанне падводзіць да тэмы ўрока). Вучні называюць тэму ўрока – “Азотная кіслата”.
Пастаноўка праблемы: Ці праўдзівае меркаванне, што пры ўзаемадзеянні азотнай кіслаты з металамі ўтвараюцца наступныя прадукты: NH3; N2; N2O; NO; NO2?
Вучні ставяць задачы ўрока: пазнаёміцца з фізічнымі і хімічнымі ўласцівасцямі, спосабам атрымання і прымянення азотнай кіслаты.
3 Тлумачэнне новага матэрыялу
Мэта: арганізаваць пазнаваўчую дзейнасць вучняў. (Вучні самі здабываюць веды. Настаўнік карэкціруе).
Будова азотнай кіслаты

Атрыманне
– А хто і калі ўпершыню атрымаў азотную кіслату? Глаўбер Ёган Рудольф (1604–1670), нямецкі хімік і лекар. Атрымаў чыстую азотную кіслату ў 1650–годзе дзеяннем канцэнтраванай сернай кіслаты на нітрат натрыю. Гэта быў лабараторны спосаб атрымання азотнай кіслаты.
– Запішыце ўраўненне рэакцыі.
NaNO3(цв) + H2SO4(к) = NaHSO4 + HNO3
– А як жа атрымліваюць азотную кіслату ў прамысловасці? Раскрыць гэта вы зможаце, расшыфраваўшы яшчэ адно пасланне. Тэкст яго такі.
Пры каталітычным акісленні бясколернага, атрутнага газу А з характэрным рэзкім пахам утворыцца рэчыва Б. Рэчыва Б лёгка акісляецца кіслародам паветра пры звычайных умовах і ператвараецца ў рэчыва В бурага колеру. Пры растварэнні ў вадзе і лішку кіслароду рэчыва В утвараецца толькі рэчыва Г. Вызначце рэчывы А, Б, В, Г. Састаўце ланцужок ператварэнняў з удзелам гэтых рэчываў і ажыццявіце яго. (А – NH3; Б – NO; В – NO2; Г – HNO3)
Вучні павінны запісаць ператварэнні:

Фізічныя ўласцівасці
– Канцэнтраваная азотная кіслата HNO3 (60–65 %) – бясколерная вадкасць, якая “дыхае на паветры”, з едкім пахам. Канцэнтраваная 100 % HNO3 часам афарбаваная ў жаўтлявы колер, паколькі яна лятучая і няўстойлівая, і пры пакаёвай тэмпературы раскладаецца з вылучэннем аксіду азоту (IV) або “бурага” газу (менавіта таму яе захоўваюць у бутэльках з цёмнага шкла).
Запісваю ўраўненне хімічнай рэакцыі раскладання азотнай кіслаты:
![]()
– Азотная кіслата гіграскапічная, змешваецца з вадой у любых адносінах. У водных растворах – моцны электраліт, пры тэмпературы –41,6°С дубянее. На практыцы прымяняецца 65 % азотная кіслата, яна не дыміць, у адрозненне ад 100 %.
Хімічныя ўласцівасці
– Вам вядома, што ўсе раней вывучаныя намі кіслоты праяўлялі агульныя хімічныя ўласцівасці. Якія гэта былі кіслоты? А з чым яны ўзаемадзейнічалі?
– Тады ў мяне да вас такое пытанне: а ці характэрны для азотнай кіслаты агульныя ўласцівасці кіслот? Каб гэта высветліць, я прапаную правесці хімічны эксперымент.
Пасля паўтарэння тэхнікі бяспекі на ўроках хіміі:
1. Дысацыяцыя ў водным растворы:
HNO3 = H+ + NO3—
2. Узаемадзеянне з асноўнымі аксідамі:
HNO3 + СuO = Cu(NO3)2 + H2O
3. Узаемадзеянне з асновамі
HNO3 + Fe(OH)2 = Fe(NO3)2 + H2O
4. Узаемадзеянне з солямі больш слабых і больш лятучых кіслот:
HNO3 + Na2CO3 = NaNO3 + H2O + CO2
5. Раскладанне пры награванні і/або на святле:
4 HNO3 = 2H2O + 4NO2 + O2
– А рэакцыю з якімі рэчывамі мы не правялі ў хімічным эксперыменце? (З металамі.)
– Вядома, азотная кіслата рэагуе з металамі, але не так, як іншыя кіслоты. Давайце паглядзім відэадослед рэакцый узаемадзеяння азотнай кіслаты з рознымі металамі (Відэадослед).
– Чаму азотная кіслата незвычайная ва ўзаемадзеянні з металамі? Разабрацца нам у гэтым дапаможа памятка “Узаемадзеянне азотнай кіслаты з металамі”. Яна ў вас ёсць на партах, вазьміце яе і ўважліва вывучым.
6. Узаемадзеянне з металамі

– Канцэнтраваная HNO3 пры награванні ўзаемадзейнічае з Fe, Al, Cr з вылучэннем NO2.
– Канцэнтраваная HNO3 на холадзе не рэагуе з Al, Co, Fe, Pb, Cr.
– І разбаўленая, і канцэнтраваная азотная кіслоты не рэагуюць з Au, Pt, Os, Ta, Ir ні пры якіх умовах.
7. Узаемадзеянне з неметаламі:
6HNO3(k) + S = H2SO4 + 6NO2 + 2H2O
5HNO3(p) + 3P + 2H2O = 3H3PO4 + 5NO
– Азотная кіслата здольная акісляць як складаныя неарганічныя рэчывы, так і арганічныя.
– Ксантапратэінавая рэакцыя. Праводзяць для выяўлення бялкоў, якія змяшчаюць у сваім складзе араматычныя амінакіслоты. Да раствору бялку дадаём канцэнтраваную азотную кіслату. Структура бялку разбураецца. Пры награванні афарбоўка становіцца жоўтага колеру (матэрыял 10-га класа, біялогія)
Солі азотнай кіслаты
– Нітраты – белыя крышталічныя рэчывы. Моцныя электраліты, у растворах цалкам дысацыіруюць на іоны. Уступаюць у рэакцыі абмену. Пры награванні ўсе нітраты разбураюцца, але састаў прадуктаў раскладання залежыць ад становішча металу солі ў радзе актыўнасці металаў.
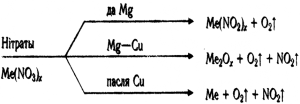
– Якія прамысловыя прадпрыемствы накіраваны на вытворчасць нітратаў і азотнай кіслаты?
Работа з падручнікам на с. 211.
4 Фізкультхвілінка (гімнастыка для вачэй)
5 Кантрольна-карэкцыйны этап
Мэта: садзейнічаць усведамленню вучнямі ўласнага ўзроўню засваення ведаў.
Практыкаванні на замацаванне
Праверачны тэст
Варыянт 1
1. Толькі несолеўтваральныя аксіды размешчаны ў радзе:
а) N2O, N2O5;
б) N2O, NO;
в) N2O3, NO;
г) N2O, NO2.
2. Ацаніце справядлівасць сцвярджэнняў:
А. Аксід азоту (IV) – буры атрутны газ.
Б. Аксід азоту (IV) – несолеўтваральны аксід, які не рэагуе з вадой.
а) правільнае толькі А;
б) правільнае толькі Б;
в) правільныя абодва сцвярджэнні;
г) абодва сцвярджэнні няправільныя.
3. Разбаўленая азотная кіслата ўзаемадзейнічае з кожным з трох рэчываў:
а) золата, фосфар, медзь;
б) серабро, карбанат натрыю, кальцый;
в) серабро, плаціна, цынк;
г) золата, гідраксід калію, жалеза.
4. Газ, які ўтвараецца пры ўзаемадзеянні магнію з разбаўленай азотнай кіслатой:
а) H2;
б) N2O;
в) NO;
г) NO2.
5. Устанавіце адпаведнасць:

Варыянт 2
1. Толькі солеўтваральныя аксіды размешчаны ў радзе:
а) NO2, N2O5;
б) N2O, NO;
в) N2O3, NO;
г) N2O, NO2.
2. Ацаніце справядлівасць сцвярджэнняў:
А. Аксід азоту (II) – буры атрутны газ.
Б. Аксід азоту (II) – несолеўтваральны аксід, які не рэагуе з вадой.
а) правільнае толькі А;
б) правільнае толькі Б;
в) правільныя абодва сцвярджэнні;
г) абодва сцвярджэнні няправільныя.
3. Канцэнтраваная азотная кіслата ўзаемадзейнічае на холадзе з кожным з трох рэчываў:
а) золата, фосфар, медзь;
б) алюміній, золата, жалеза;
в) серабро, плаціна, цынк;
г) магній, аксід кальцыю, гідраксід натрыю.
4. Газ, які ўтвараецца пры ўзаемадзеянні ртуці з канцэнтраванай азотнай кіслатой:
а) H2;
б) N2O;
в) NO;
г) NO2.
5. Устанавіце адпаведнасць:

Ключ адказаў
Самакантроль, карэкцыя і самаацэнка ведаў і ўменняў.
Заданні
1. Метадам электроннага балансу расстаўце каэфіцыенты ва ўраўненнях рэакцый з удзелам азотнай кіслаты:
S + HNO3(канц.) = H2SO4 + NO2↑ + H2O;
Mg + HNO3(канц) = Mg(NO3)2 + N2 + H2O.
2. Рашыце задачу.
Разлічыце хімічную колькасць, масу і аб’ём(н.у.) кіслароду, што вылучыцца пры тэрмічным раскладанні нітрату калію хімічнай колькасцю 5 моль.
6 Дамашняе заданне
§ 38, выканаць заданні 4–7.
7 Рэфлексія
Мэта: усведамленне значнасці вучэбнай дзейнасці і сітуацыі поспеху.
– У ходзе ўрока вы спрабавалі авалодаць самым галоўным у працэсе пазнання – уменнем знаходзіць ісціну з дапамогай доказаў, гэта значыць праводзіць даследаванні. Многія навукоўцы мінулых стагоддзяў абапіраліся ў сваіх пошуках толькі на інтуіцыю і ў выніку нярэдка памыляліся. Вы ж з дапамогай доследаў знайшлі сваю ісціну.
– Ці дасягнулі мы пастаўленых задач?
– Над якім матэрыялам яшчэ неабходна працаваць?




 Предложить публикацию
Предложить публикацию