 Аляксандр ШЭЛЯСТОВІЧ,
Аляксандр ШЭЛЯСТОВІЧ,
настаўнік фізікі
ДУА “Азёркаўская сярэдняя школа”
Мастоўскага раёна,
Гродзенская вобласць
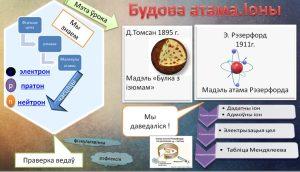
Тэма ўрока: Будова атама. Іоны.
Тып урока: урок вывучэння новага матэрыялу.
Мэты:
адукацыйныя
– забяспечыць засваенне вучнямі ведаў аб будове атама, паняццяў «электрон», «пратон», «дадатны іон», «адмоўны іон»;
– навучыцца карыстацца перыядычнай сістэмай элементаў Мендзялеева для вызначэння складу атама;
развіваючыя
– сфарміраваць уменне здабываць інфармацыю з розных крыніц і прадстаўляць яе ў розных відах (схеме, малюнку, табліцы);
– развіць у вучняў такія інфармацыйныя ўменні, як работа з тэкстам, малюнкам, схемай, даведачнай літаратурай, табліцай;
– развіць уменні здзяйсняць разумовыя аперацыі;
выхаваўчыя
– развіваць пазнавальную цікавасць да прадмета;
– паказаць значэнне доследаў вядомых фізікаў.
Задачы:
– забяспечыць засваенне навучэнцамі вучэбнага матэрыялу ў працэсе актыўнай інфармацыйна-разумовай дзейнасці з рознымі крыніцамі інфармацыі;
– задзейнічаць як мага больш аперацый мыслення навучэнцаў.
Выкананне пастаўленых мэт і задач дасягаецца за кошт арганізацыі дыялогу, эўрыстычнай гутаркі і дыскусіі, уцягвання вучняў у актыўную пазнавальную дзейнасць.
Інтэрактыўны плакат ўрока са спасылкамі на ітнэрнет-рэсурсы выкарыстоўваецца на працягу ўсяго ўрока.
Ход урока
1 Арганізацыйны момант і матывацыя
– Слова “атам” з’явілася больш за 2500 гадоў таму ў працах старажытнагрэчаскага філосафа Дэмакрыта. З грэчаскага “атам” перакладаецца як “непадзельны”. Вы ўжо ведаеце, што ўвесь наш сусвет сладаецца з матэрыі. Звернемся да экрана мультыборда.
– Матэрыя складаецца з фізічных цел. Фізічныя целы складаюцца з рэчыва – з малекул і атамаў. На мінулым уроку мы даведаліся, што ёсць часціцы, якія ўваходзяць у склад атама – гэта электрон і пратон. Акрамя гэтага вучоныя, праводзячы даследаванні, вынайшлі яшчэ адну часціцу, якая называецца нейтрон.

Слухаем кароткія паведамленні вучняў пра адкрыццё часціц, адначасова разглядаем на слайдзе інфармацыю пра часціцы, звяртаючы ўвагу на зарад і масу часціц.
– Так у нас узнікае пытанне, дзе гэтыя часціцы знаходзяцца ў атаме, якая будова атама? Перш чым высветлім гэта больш падрабязна, давайце паставім мэту сённяшняга ўрока. Вучні выказваюць свае думкі.

– Такім чынам мэта ўрока: вывучыць будову атама.
2 Паўтарэнне вывучанага матэрыялу (праводзіцца ў выглядзе тэста, які абмяркоўваецца з вучнямі франтальна).
Настаўнік ацэньвае веды вучняў выбарачна.
Мэта: праверыць замацаванне ведаў вучняў па тэме “Электрычны зарад”.

3 Вывучэнне новага матэрыялу
1) Мадэль атама Томсана


– У 1897 годзе быў адкрыты электрон (уваходны ў склад атама) і быў зроблены вывад аб складанай будове атама. Спроб стварыць будову атама было шмат, але ўвагі заслугоўвае мадэль атама англійскага фізіка Джозефа Томсана. Гэта была першая дастаткова распрацаваная мадэль атама.
Згодна з тэорыяй Томсана атам уяўляе сабой шар, па ўсім аб’ёме якога раўнамерна размеркаваны дадатны зарад, а адмоўна зараджаныя электроны, падобна разынкам у “кексе”, “булцы”, знаходзяцца ў гэтым дадатным асяроддзі.
Гэтая мадэль атрымала назву “кекс”, “пудынг”, так як электроны былі ўкрапаныя ў дадатнае асяроддзе, падобна разынкам у кексе або пудынгу. Зарад усіх электронаў роўны па модулі дадатнаму зараду асяроддзя, таму атам нейтральны.
Мадэль атама Томсана здавалася прывабнай з таго пункту гледжання, што меркавала наяўнасць электронаў у атаме. А сам Томсан з дапамогай дадзенай мадэлі растлумачыў шэраг фізічных з’яў, напрыклад, добрая праводнасць металаў тлумачылася тым, што атамы металаў лёгка губляюць частку электронаў. Томсан у 1902 годзе прапанаваў праверыць эксперыментальна сваю мадэль атама вучню Э.Рэзерфорду, які ў той час кіраваў лабараторыяй Оксфардскага ўніверсітэта. Праводзячы доследы Э.Рэзерфорд у 1911 годзе выявіў неадпаведнасць мадэлі атама Томсана з вынікамі праведзеных вопытаў.
2) Доследы Рэзерфорда (разглядаем інтэрактыўны плакат з мадэлямі доследу)

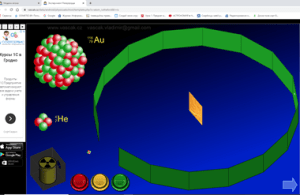
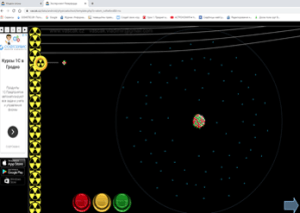
– Англійскі фізік Э.Рэзерфорд, даследуючы выпраменьванне радыеактыўных рэчываў, асаблівую ўвагу надаў выпраменьванню, якое складаецца са дадатна зараджаных часціц, званых альфа-часціцамі. Пучок альфа-часціц прапускаўся праз тонкую залатую фольгу. Альфа-часціцы, якія праходзілі праз фольгу, пападалі на экран з сярністага цынку і выклікалі ўспышку святла, якую рэгістраваў мікраскоп. Згодна з прапанаванай Томсанам мадэллю атама, альфа-часціцы павінны былі б свабодна праходзіць скрозь атамы золата і толькі асобныя альфа-часціцы маглі злёгку адхіляцца ў электрычным полі электрона. Таму варта было чакаць, што пучок альфа-часціц пры праходжанні праз тонкую фольгу злёгку расплывецца на невялікія вуглы. Такое рассейванне на малыя вуглы сапраўды назіралася, але зусім нечакана аказалася, што прыкладна адна альфа-часціца з 20000 вяртаецца назад у бок крыніцы гэтых часціц. Рэзерфорду спатрэбілася некалькі гадоў, каб канчаткова зразумець гэтае нечаканае рассейванне альфа-часціц на вялікія вуглы. Ён прыйшоў да высновы, што дадатны зарад атама засяроджаны ў вельмі малым аб’ёме – у цэнтры атама, а не размеркаваны па ўсім атаме, як у мадэлі Томсана.
3) Ядзерная мадэль атама Рэзерфорда (дэманстрацыя мадэлі атама)
– Такім чынам, Рэзерфорд прапанаваў ядзерную мадэль атама. У цэнтры атама знаходзіцца дадатна зараджанае ядро, а вакол ядра рухаюцца адмоўна зараджаныя электроны. Ядро складаецца з дадатных пратонаў і нейтронаў, якія не маюць зараду.
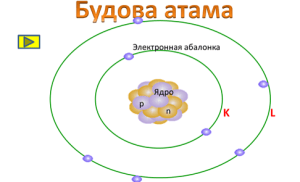
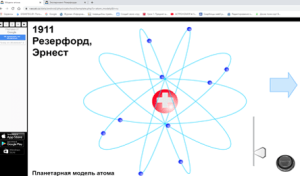
Фізкультхвілінка. Лірычнае адступленне
Паэт В.Брусаў у 1922 годзе пад уражаннем дзівосных адкрыццяў фізікаў так пісаў пра мадэлі электрона і атама:
Быть может, эти электроны –
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков!
Еще, быть может, каждый атом –
Вселенная, где сто планет;
Там все, что здесь, в объеме сжатом,
Но также то, чего здесь нет.
– Што меў на ўвазе У.Брусаў, параўноўваючы электроны з планетамі, а атамы з Сусветам?
– Як вы разумееце апошнія два радкі верша?
Выказванні вучняў (планетрная мадэль атама).

– Якія з’явы дапамагла нам растлумачыць мадэль атама Рэзерфорда? (Глядзім інтэрактыўны плакат).
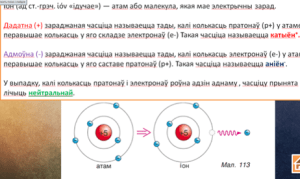
– Іоны. Іон (ад ст.-грэч. “ідучае”) – атам або малекула, якая мае электрычны зарад.
Дадатна (+) зараджанай часціца будзе з’яўляцца тады, калі колькасць пратонаў (p+) у атаме перавышае колькасць электронаў (e-). Такая часціца называецца катыён+.
Адмоўна (-) зараджанай часціца будзе з’яўляцца тады, калі колькасць электронаў (e-) у атаме перавышае колькасць пратонаў (p+). Такая часціца называецца аніён-.
У выпадку, калі колькасць пратонаў і электронаў роўна адзін аднаму, часціцу прынята лічыць нейтральнай.
– Электрызацыя цел
Атам у цэлым нейтральны, гэта значыць, сума дадатных зарадаў пратонаў па модулі роўная суме адмоўных зарадаў электронаў. А паколькі па модулі зарады пратона і электрона роўныя, то колькасць пратонаў роўна колькасці электронаў. Калі цела набывае адмоўны зарад, то яно набывае лішкавыя электроны, а калі дадатны – губляе электроны.
– Табліца Мендзялеева

Будова ўсіх атамаў зашыфравана ў перыядычнай табліцы Д.І.Мендзялеева. Парадкавы нумар хімічнага элемента паказвае электрычны зарад ядра атама, гэты зарад роўны суме пратонаў у ядры атама, а, значыць, і колькасці электронаў. (Далей прыводзяцца прыклады будовы атама вадароду, гелію, літыя).
Вучні робяць вывады, як знаходзіць лік пратонаў, нейтронаў і электронаў.
Настаўнік прапануе запоўніць табліцу, выкарыстоўваючы маркёр, вучні запаўняюць табліцу на мультыбордзе.

4 Замацаванне матэрыялу
Прапануецца тэст з 10 заданнямі па тэме “Будова атама і іоны”. Тэст разглядаецца ўсімі вучнямі франтальна, адказы вучняў ацэньваюцца настаўнікам.

5 Падвядзенне вынікаў
– Успомнім тое, што мы сёння рабілі і пра што даведаліся. Для гэтага адкажыце на пытанні:
– Якімі крыніцамі інфармацыі для атрымання новых ведаў вы карысталіся на ўроку?
– Што новага вы даведаліся аб паняцці “атам”?
– Чаму вы на ўроку навучыліся?
6 Рэфлексія
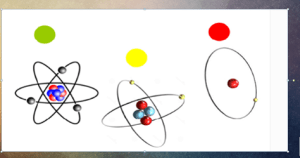
Вы бачыце малюнак, на якім намаляваны атам. Стабільнасць ядраў залежыць ад колькасці пратонаў і нейтронаў, якія ўваходзяць у яго склад. Пасля заканчэння ўрока пакіньце, калі ласка, на парце картку таго колеру, якая адпавядае стабільнасці вашых ведаў аб ядры атама, атрыманых на сённяшнім уроку.
7 Дамашняе заданне
§ 16, кантрольныя пытанні пасля параграфа.



 Предложить публикацию
Предложить публикацию