Цель урока: формирование представления о химических свойствах карбоновых кислот, обусловленных их строением.
Светлана ОРЛОВСКАЯ,
учитель химии
ГУО «Гимназия г. Ляховичи»,
Брестская область
Цель: формирование представления о химических свойствах карбоновых кислот, обусловленных их строением.
Тип урока: комбинированный.
Формы учебной работы: фронтальная, индивидуальная, работа в группах.
Оборудование: мультиборд, презентация PowerPoint, раздаточный материал
Эпиграф: «Всякое вещество – от самого простого до самого сложного – имеет три различные, но взаимосвязанные стороны – свойство, состав, строение» (В.М.Кедров).
Ход урока
1 Организационный момент
2 Актуализация знаний
Сегодня на уроке вы сами попробуете прогнозировать химические свойства класса карбоновых кислот. А чтобы успешно с этим справиться, мы должны сейчас поработать: несколько человек будут работать у доски по карточкам, а остальные – со мной.
Работа у доски
1-й ученик. Запишите структурные формулы трех первых представителей гомологического ряда насыщенных карбоновых кислот, назовите их и приведите общую формулу ряда.
2-й ученик. Составьте структурные формулы изомерных насыщенных одноосновных кислот, соответствующих составу С6Н12О2, и приведите их названия по номенклатуре ИЮПАК.
3-й ученик. Определите молекулярную формулу насыщенной одноосновной карбоновой кислоты, если массовая доля углерода в составе молекулы равна 0,485.
Работа с классом
Задание 1. Я предлагаю вам игру, которая называется «Кот в мешке». (Демонстрирую слайды с написанными формулами, учащиеся должны назвать вещества и указать класс соединений, которому данные вещества принадлежат):
C5H12 , C2H2, C2H4 , C6H6 , C2H5OH, CH3CHO, CnH2n+1CHO, CnH2n+1OH, CnH2n+2 , CnH2n , CnH2n-2
Задание 2. Назовите вещество, о котором идет речь.
А) Антиоксидант, выводит из организма токсины и канцерогенные вещества, укрепляет иммунитет. (Аскорбиновая кислота)
Б) Это вещество одно из самых древних. Его используют как приправу к пельменям или как консервирующее средство при заготовке маринованных огурцов, помидоров или грибов. Без этого вещества не удается получить искусственный шелк, аспирин. А жители Древней Эллады называли его «оксас». (Уксусная кислота)
В) Принимает активное участие в жизненных процессах. Ещё в прошлом веке И.И.Мечников заметил, что питание молочнокислой продукцией очищает кишечник от гнилостной микрофлоры и способствует долголетию. (Молочная кислота)
Г) Широко используется в косметической промышленности: её натриевая соль является одним из основных компонентов мыла, сама кислота входит в состав многих косметических средств. Применяется в производстве свечей. (Стеариновая кислота)
Д) В 1714 году по указу Петра I в Петербурге был заложен аптекарский сад. Там выращивали лекарственные растения, снабжая ими аптеки или перерабатывая их на лекарства. Так вот, листья одного из таких растений, помещенные в молоко, предохраняют его от скисания. Свежее мясо и рыба, переложенные этим растением, дольше сохраняются. Из его корней можно получить желтый краситель. Из волокон можно изготовить сети, не гниющие в воде. Листья – неистощимая основа для фантазии хозяйки по приготовлению здоровой и полезной пищи. Мы знаем это растение по сказке Андерсена. Личный опыт общения с этим растением способен довести до слез. Наконец, это растение узнают даже слепые. (Крапива, муравьиная кислота).
Разбор заданий, выполненных на доске (с привлечением класса)
Итак, тема нашего урока: «Химические свойства насыщенных одноосновных карбоновых кислот».
3 Целеполагание
В карбонильной группе электронная плотность смещена от атома углерода к атому кислорода, поэтому на карбонильном углероде возникает частично положительный заряд. Атом углерода, компенсируя этот положительный заряд, притягивает к себе неподеленную пару электронов атома кислорода гидроксильной группы. В свою очередь, атом кислорода оттягивает на себя электронную плотность связи О – Н, т.о. атом водорода в ней становится очень подвижным.
Атом водорода приобретает повышенную подвижность, что существенно упрощает его отрыв в виде катиона.
Одной из ведущих идей науки химии является зависимость свойств веществ от их состава и строения, изучить и подтвердить которую нам сегодня предстоит. Какие химические свойства характерны для карбоновых кислот? Существует ли связь между строением молекул карбоновых кислот и их свойствами?
Давайте определимся с задачами на текущий урок (учащиеся предлагают):
– изучить химические свойства одноосновных насыщенных карбоновых кислот;
– установить существование причинно-следственных связей между строением и свойствами карбоновых кислот;
– развивать умения анализировать, сравнивать, сопоставлять.
4 Изучение нового материала
Организую самостоятельную работу с текстом, выданным учащимся. Читая текст, учащиеся маркируют его, руководствуясь памяткой. Время работы с текстом – 5 минут.
Внимательно читая текст, отмечай значками на полях (справа или слева), насколько новая и понятная для тебя информация:
«+» – уже знал;
«−» – новое;
«!» – думал иначе;
«?» – не понял, есть вопросы
Текст для учащихся «Химические свойства карбоновых кислот»
Многие химические свойства кислот объясняет электронно-структурная формула:
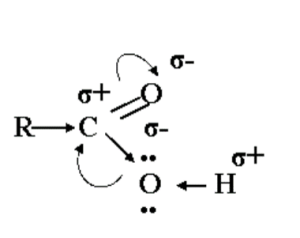
1. Карбоновые кислоты – более сильные, чем спирты, поскольку атом водорода в карбоксильной группе (СООН) обладает повышенной подвижностью благодаря влиянию карбонильной группы (СО). В водном растворе карбоновые кислоты диссоциируют: RCOOH↔ RCOO– + Н+.
Но из-за ковалентного характера молекул карбоновых кислот указанное выше равновесие диссоциации достаточно сильно сдвинуто влево. Таким образом, карбоновые кислоты – это, как правило, слабые кислоты.
2. Образование солей. Карбоновые кислоты благодаря подвижности атома водорода карбоксильной группы обладают всеми свойствами неорганических кислот.
Они реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот:
2RCOOH + Ca → (RCOO)2Ca +Н2↑
2RCOOH + MgО → (RCOO)2Mg +Н2О
RCOOH + NaOH → RCOONa + Н2О
2RCOOH + K2CO3 → 2RCOOK +СО2↑ + Н2О
3. Ряд свойств карбоновых кислот обусловлен наличием углеводородного радикала. Так, при действии галогенов на кислоты в присутствии красного фосфора образуются галогензамещенные кислоты, причем на галоген замещается атом водорода при соседнем с карбоксильной группой атоме углерода:
RCH2− COOH + Br2 → RCHBr − COOH + HBr
4. В атмосфере кислорода карбоновые кислоты окисляются до оксида углерода (IV) и воды
RСООН + O2 → CO2↑ + Н2О
5. Образование сложных эфиров. Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
H2SO4, t0
RCOOH + НОR1 ↔ RCOOR1 + H2O
6. а) В присутствии водоотнимающих средств (H2SO4 (конц.)) муравьиная кислота отщепляет воду с выделением оксида углерода (II).
б) Из-за наличия в молекуле НСООН альдегидной группы муравьиная кислота легко окисляется, т.е. дает реакцию «серебряного зеркала» и взаимодействует с гидроксидом меди (II) при нагревании с образованием осадка краснокирпичного цвета.
Совместный анализ маркировки текста, выделяя новые знания (5 минут).
Далее делю класс на три группы, каждая группа получает свои задания (время для работы над заданиями – 7 минут).
Задание для группы № 1
1. Выберите (из данного перечня 1–10) уравнения химических реакций, характеризующие общие свойства карбоновых кислот, что их сближает со всеми кислотами (неорганическими и органическими).
2. Составьте кластер.
Задание для группы № 2
1. Выберите (из данного перечня 1–10) уравнения химических реакций, характеризующие общие свойства карбоновых кислот, что их сближает только с органическими кислотами.
2. Составьте кластер.
Задание для группы № 3
1. Выберите (из данного перечня 1–10) уравнения химических реакций, характеризующие индивидуальные свойства муравьиной кислоты, что её отличает от других карбоновых кислот.
2. Составьте кластер
Перечень уравнений реакций (для учащихся)

5 Закрепление знаний
Создание одного общего кластера с комментариями (7 минут)



 Предложить публикацию
Предложить публикацию